|
Состояния данной массы газа характеризуется тремя макроскопическими параметрами: давлением, объемом, температурой. В данной главе рассмотрим между ними связь, а затем посмотрим, для чего эта связь нужна.
Уравнение состояния идеального газа
– называется такое уравнение, которое связывает три макроскопических параметра давление P
, объем V
и температуру T
, для достаточно разряженного газа.
Выведем уравнение состояния идеального газа. Для этого подставим в уравнение:
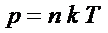 (1 (1
)
выражение для концентрации молекул газа  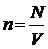 , концентрацию газа можно записать так: , концентрацию газа можно записать так:
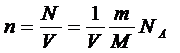 (2 (2
)
где 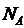 -постоянная Авогадро, m -постоянная Авогадро, m
– масса газа, M
– его молярная масса.
После подстановки (2
) в (1
) будем иметь
 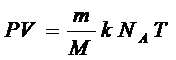 (3 (3
)
где k– постоянная Больцмана. Произведение постоянной Больцмана k и постоянной Авогадро 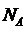 называется универсальной (молярной) газовой постоянной называется универсальной (молярной) газовой постоянной
и обозначается буквой R.
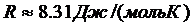
Подставим универсальную газовую постоянную в уравнение (3
), получим уравнение состояния для произвольной массы идеального газа:
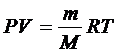 (4 (4
)
Единственная величина в этом уравнении (4
), зависящая от рода газа, это его молярная масса.
Уравнение (4
) называется уравнение состояния идеального газа
или уравнение Менделеева – Клапейрона.
Из уравнения состояния вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояниях.
Если индекс 1
обозначить параметры, относящиеся к первому состоянию, а индекс 2
- параметры, относящиеся ко второму состоянию, то согласно уравнению (4
) для газа данной массы:
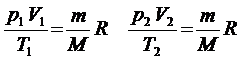
Правые части этих уравнений одинаковы, следовательно, должны быть равны и их левые части:
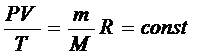 (5 (5
)
Уравнение состояние в форме (5
) называется уравнением Клапейрона и представляет собой одну из форм записи уравнения состояния.
Таким образом, для данной массы газа, как бы ни менялись его давление, объем и температура, произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная.
|