|
Состав атомного ядра. Эксперименты Резерфорда показали, что атомы имеют очень малое ядро, вокруг которого вращаются электроны. По сравнению с размерами ядра, размеры атомов огромны и, поскольку практически вся масса атома заключена в его ядре, большая часть объёма атома фактически является пустым пространством. Атомное ядро состоит из нейтронов и протонов. Элементарные частицы, образующие ядра (нейтроны и протоны) — называются нуклонами. Протон (ядро атома водорода) обладает положительным зарядом +е, равным заряду электрона и имеет массу в 1836 раз больше массы электрона. Нейтрон — злектрически нейтральная частица с массой примерно равной 1839 масс электрона.
Количество протонов Z в ядре нейтрального атома равно числу электронов в его электронной оболочке и определяет его заряд, равный +Ze. Число Z называется зарядовым числом и определяет порядковый номер химического элемента периодической системы Менделеева. N — число нейтронов в ядре, А — массовое число, равное суммарному количеству протонов Z и нейтронов N в ядре. Ядро атома обозначается тем же символом, что и химический элемент, снабжаясь двумя индексами (например, 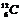 ), из которых верхний обозначает массовое, а нижний зарядовое число. ), из которых верхний обозначает массовое, а нижний зарядовое число.
Изотопами
называются ядра с одним и тем же зарядовым числом и различными массовыми числами.
Большинство химических элементов имеет несколько изотопов. Они обладают одинаковыми химическими свойствами и занимают одно место в таблице Менделеева. Например, водород имеет три изотопа: протий (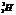 ), дейтерий ( ), дейтерий (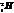 ) и тритий ( ) и тритий (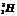 ). У кислорода встречаются изотопы с массовыми числами А = 16, 17, 18. В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают почти одинаковыми физическими свойствами (исключение составляют, например, изотопы водорода) ). У кислорода встречаются изотопы с массовыми числами А = 16, 17, 18. В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают почти одинаковыми физическими свойствами (исключение составляют, например, изотопы водорода)
Приближённо размеры ядра были определены в опытах Резерфорда по рассеянию a-частиц. Наиболее точные результаты получаются при изучении рассеяния быстрых электронов на ядрах. Оказалось, что ядра имеют примерно сферическую форму и её радиус зависит от массового числа А по формуле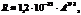 м. м.
|