|
Колебательная часть термодинамических величин газа становится существенной при значительно более высоких температурах, чем вращательная, потому что интервалы колебательной структуры термов велики по сравнению с интервалами вращательной структуры.
Мы будем считать, однако, температуру большой лишь настолько, чтобы были возбуждены в основном не слишком высокие колебательные уровни. Тогда колебания являются малыми (а потому и гармоническими), и уровни энергии определяются обычным выражением ħw(u + 1/2).
Число колебательных степеней свободы определяет число так называемых нормальных колебаний молекулы, каждому из которых соответствует своя частота wa (индекс a нумерует нормальные колебания). Надо иметь в виду, что некоторые из частот wa могут совпадать друг с другом; в таких случаях говорят о кратной частоте.
Вычисление колебательной статистической суммы Zкол производится элементарно. Вследствие очень быстрой сходимости ряда суммирование можно формально распространить до u=¥. Условимся отсчитывать энергию молекулы от наиболее низкого (u = 0) колебательного уровня, т. е. включаем ħw/2 в постоянную e0 в 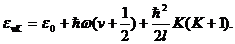
В гармоническом приближении, когда мы считаем колебания малыми все нормальные колебания независимы, и колебательная энергия есть сумма энергий каждого колебания в отдельности. Поэтому колебательная статистическая сумма 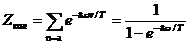 , ,
распадается на произведение статистических сумм отдельных колебаний,
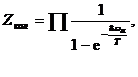
а для свободной энергии FKOJl получается сумма выражений
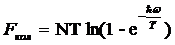 , ,
т. е. 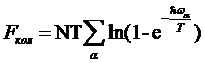
В эту сумму каждая частота входит в числе раз, равном ее кратности. Такого же рода суммы получаются соответственно для колебательных частей других термодинамических величин.
Каждое из нормальных колебаний дает в своем классическом предельном случае (T>>ħwa) вклад в теплоемкость, равный c(a)кол = 1 при Т, большем наибольшего из ħwa , получилось бы скол = rкол . Фактически, однако, этот предел не достигается, так как многоатомные молекулы обычно распадаются при значительно более низких температурах.
Различные частоты wa многоатомной молекулы разбросаны обычно в очень широком интервале значений. По мере повышения температуры постепенно «включаются» в теплоемкость различные нормальные колебания. Это обстоятельство приводит к тому, что теплоемкость многоатомных газов в довольно широких интервалах температуры часто можно считать примерно постоянной.
Упомянем о возможности своеобразного перехода колебаний во вращение, пример которого представляет молекула этана С2Н6. Эта молекула построена из двух групп СН3, находящихся на определенном расстоянии друг от друга и определенным образом взаимно ориентированных. Одно из нормальных колебаний молекулы представляет собой «крутильное колебание», при котором одна из групп СН3 поворачивается относительно другой. При увеличении энергии колебаний их амплитуда растет и в конце концов, при достаточно высоких температурах, колебания переходят в свободное вращение. В результате вклад этой степени свободы в теплоемкость, достигающий при полном возбуждении колебаний примерно величины 1, при дальнейшем повышении температуры начинает падать, асимптотически приближаясь к характерному для вращения значению 1/2.
Наконец, укажем, что если молекула обладает отличным от нуля спином S (например, молекулы NO2, C1O2), то к химической постоянной добавляется величина
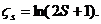
|