|
Другая проблема, которую не могла решить классическая физика, это существование атомов химических элементов с определенными свойствами. Принятая после опытов Резерфорда планетарная модель атома в рамках классических представлений оказалась неприемлемой.
Прежде всего, электрон при ускоренном движении по орбите (центростремительное ускорение!) должен терять энергию, излучая электромагнитную волну. Кроме того, в рамках классических представлений невозможно объяснить, почему атом меди, например, всегда остается атомом меди независимо от того, каким способом, где и когда была получена медь.
Звездные системы со своими планетами, которые дали название принятой в физике модели атома, обязательно различны. И не удивительно - движение планет описывается классической физикой. Так почему атомы, образованные квантовыми объектами, идентичны? Ответ, мне кажется, достаточно ясен:
“Во многих отношениях электронные орбиты демонстрируют поразительное сходство с волновыми колебаниями, локализованными в пределах атома. Например, волна, ограниченная определенным объемом, т.е. стоячая волна
, может иметь только определенное число конфигураций . Эти конфигурации вполне определенны и имеют простые симметричные структуры - факт, известный из наблюдения других стоячих волн, например, колебаний скрипичной струны или волн в воздушном столбе органной трубы. Они обладают свойством «восстановления»; если возмущающий эффект изменил их форму, первичная конфигурация волн восстанавливается, когда действие возмущения прекращается.”
Итак, стабильность атома обеспечивается волновыми свойствами электронов. Но для понимания квантовых объектов важно еще понимание того, что определенной конфигурации стоячей электронной волны отвечает определенная энергия. Мы это видели на примере бесконечно глубокой одномерной потенциальной ямы.
В то же время следует знать и помнить, что уравнением Шрёдингера описываются отнюдь не все свойства электрона. Например, в нем отсутствует спин. И уж никак из этого уравнения не следует принцип Паули, согласно которому в атоме может быть лишь два электрона с некоторой определенной конфигурацией стоячей волны.
Эти конфигурации характеризуются набором квантовых чисел. Поэтому применительно к атому принцип Паули формулируется так: в атоме может существовать лишь два электрона с одинаковым набором квантовых чисел, различающиеся знаком спина. Если спиновое квантовое число 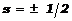 ввести в общий набор квантовых чисел, формулировка принципа Паули становится более лаконичной: каждый электрон в атоме должен иметь свой набор квантовых чисел. ввести в общий набор квантовых чисел, формулировка принципа Паули становится более лаконичной: каждый электрон в атоме должен иметь свой набор квантовых чисел.
Здесь, видимо, вновь следует обратиться к вопросу о “понятности” свойств квантового объекта, в частности, электрона. Мы не можем дать какого-то объяснения принципу Паули, равно как волновой природе квантового объекта, как, впрочем, и “понятному” закону сохранения энергии, например. Все это лишь констатация свойств природы, выясненных в результате наблюдений и экспериментов. Мы не придумываем природу, мы ее изучаем.
|