|
В XVII веке был сформулирован закон Бойля-Мариотта, выражающий зависимость давления(P) от объема (V) при постоянной температуре (Т). (Изотермический).
PV=const 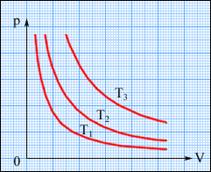
XVIII век, Шарль, закон для изохорного процесса, V=const. 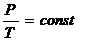 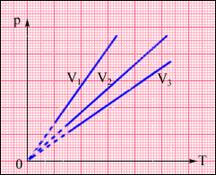
XIX век, Гей-Люссак, изобарный процесс, P=const. 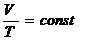 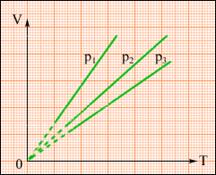
На практике же чаще всего все три параметра меняются одновременно.
Клапейрон вывел следующий закон: 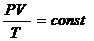
Менделеев показал, что константой в данном случае будет универсальная газовая постоянная R=8,31 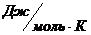
Обобщение из этого для одного моля газа приводит к уравнению:
PV=RT
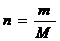
PV=nRT
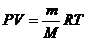 - закон, известный как уравнение Менделеева-Клапейрона. - закон, известный как уравнение Менделеева-Клапейрона.
Физический смысл универсальной газовой постоянной: R равна работе, которую совершает один моль газа при нагревании на 1 К при постоянном давлении.
Для реального газа действует уравнение Вандер-Ваальса (XIX век).
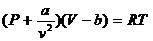
 - учитывает силы взаимодействия между молекулами реальных газов, что приводит к усилению давления – к внешнему давлению газа присоединяется внутреннее давление между молекулами. - учитывает силы взаимодействия между молекулами реальных газов, что приводит к усилению давления – к внешнему давлению газа присоединяется внутреннее давление между молекулами.
b – учитывает собственный объём молекул.
a и b можно определить только экспериментально.
Межмолекулярное взаимодействие электрически нейтральных молекул любого агрегатного состояния.
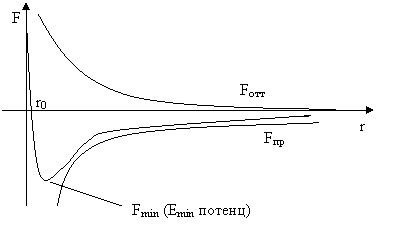
Точно так же выглядит график зависимости потенциальной энергии взаимодействия от расстояния между молекулами.
При приближении молекулы действуют две силы – притяжения и отталкивания. |
r=r0 |
Fприт=Fотт | |
r>r0 |
Fприт>Fотт | |
r<r0 |
Fприт<Fотт |
Если Eкин движ>>Епотенц взаимод, то это газообразное состояние вещества.
Если Eкин движ<<Епотенц взаимод, то это твердое состояние вещества.
Если Eкин движ≈Епотенц взаимод, то это жидкое состояние вещества.
Существуют четыре агрегатных состояния вещества. При переходы из одного состояния в другое могут наблюдаться фазовые переходы двух видов.
· Фазовые переходы первого (I) рода – когда в узком интервале температур скачком изменяется давление, плотность или объем.
· Фазовый переход второго (II) рода – это изменение порядка расположения атомов и молекул в кристаллических решетках. При таком переходе резко изменяется плотность. Например, превращение белого олова в серое при -14°С, и кристаллическая решетка из тетраэдров становится кубами.
Четвертое состояние вещества – плазма. Плазма – это ионизированный квазинейтральный газ, занимающий настолько большой объем, что в нем не происходит сколько-нибудь заметного нарушения нейтральности
Атом делится на электроны и положительные ионы. В зависимости от степени Ионизации газа различают:
1. Слабо ионизированную (низкотемпературную) плазму, α составляет доли процента, температура 1000-2000°С.
2. Умеренно ионизированную, α состоавляет несколько процентов, температура 5000-7000°С.
3. Сильно ионизированную (высокотемпературную), α=100%, температура 10000°С и выше.
Ионосфера представляет собой слабо ионизированную плазму. От нее отражаются радиоволны. В космическом пространстве плазма – это наиболее распространенное состояние вещества (все звезды, в которых идут термоядерные реакции, а таких большинство). В лабораторных условиях плазма образуется в различных формах газовых разрядов.
Основное применение молекулярно-кинетической теории:
1. Для разработки криогенной и вакуумной техники.
2. В космонавтике.
3. Исследование сверхпроводимости металлов.
4. Исследование нейтронных полей в ускорителях и ядерных реакторах (термоядерный синтез).
|