|
1. Расстояние между молекулами во много раз превышает размеры самих молекул, причем, размеры молекул применяются за материальную точку.
2. Между молекулами нет сил межмолекулярного взаимодействия.
Идеального газа не существует, но можно приблизиться к идеальному газу – при низком давлении и высокой температуре молекулы движутся, практически не задевая друг друга. Вещество звезд, находящихся на главной последовательности диаграммы Герцшпрунга-Рессела, на определенной глубине находится в состоянии, очень близком к идеальному газу, несмотря на высокую плотность (не стоит забывать об отсутствии «прикрепленных» к ядрам электронов). (Прим. авт. консп.)
Основное уравнение молекулярно-кинетической теории для идеального газа:
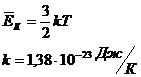
k – постоянная Больцмана.
Этот закон записан для одного моля газа.
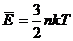 - для n-ного количества молей. Если газ одноатомный. - для n-ного количества молей. Если газ одноатомный.
Данный атом имеет три степени свободы (3 координаты, так как вращение вокруг собственной оси не учитывается. i=3
Если газ двухатомный, то i=5 (поступательное).
Если газ многоатомный, но молекула линейная, то степеней свободы будет 5, если многоатомный, но нелинейный, то 6. Все степени свободны являются равноправными и вносят одинаковый вклад в среднюю кинетическую энергию.
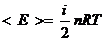
|