|
Принцип соответствия Бора: Законы квантовой механики при больших значениях квантовых чисел переходят в законы классической механики.
Вывод из этого принципа: всякая новая теория является развитием предыдущих теорий и полностью её не отвергает, а лишь указывает границы её применимости.
l – орбитальное (побочное или азимутальное) квантовое число. Характеризует (показывает) форму электронного облака и изменяется от 0 до (n-1), то есть, зависит от главного квантового числа. l определяет значение момента количества движения электрона по орбите.
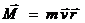
l характеризует число подуровней на заданном энергетическом уровне.
Каждому значению l соответствует орбиталь особой формы.
Орбитали с l = 0 называются s-орбиталями,
l =1 - р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 - d-орбиталями (5 типов),
l = 3 - f-орбиталями (7 типов).
m – магнитное квантовое число. Показывает ориентацию электронного облака в атоме при взаимодействии магнитного поля электрона с внешним магнитным полем и магнитными полями соседних электронов. m определяет число орбиталей на данном подуровне l (от –l до +l).
|
n=1 |
l=0(s) |
m=1 | |
n=2 |
l=0(s), 1(p) |
m=1,3
m=-1,0,1 | |
n=3 |
l=0(s),1(p),2(d) |
m=1,3,5 |
Три квантовых числа n, l и m определяют волновые свойства электрона (следует из решения уравнения Шредингера).
s – квантовое число, называемое спин.
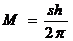
Частица с целым спином.
Принцип Паули: В атоме не может быть электронов, у которых все квантовые числа равны. Это связано с тождественностью частиц. В атоме не может быть двух электронов в одинаковых энергетических состояниях.
Принцип дополнительности Бора (сформулирован в 1927-м году): Получение экспериментальной информации об одних физических величинах, описывающих частицу, неизбежно связано с потерей информации о других величинах, дополнительных к первой.
Eкин ® Епот
v®(x,y,z)
С точки зрения физика-экспериментатора это связано с влиянием макроприбора на микроскопический объект. С точки зрения квантовой механики определить одновременно основные свойства частицы и дополнительные к ним невозможно точно ни на каком приборе, так как частицы обладают корпускулярно-волновым дуализмом.
Принцип неопределенности Гейзенберга: увеличение точности определения положения частицы вызывает увеличение ошибки определения ее момента (энергии), если эти определения проводятся одновременно.
Принцип причинности (Связан с Лапласовским детерминизмом): Если мы знаем исходное условие (причину), то всегда можем определить следствие.
Квантовая механика основывается на теории вероятностей.
Ψ0®|Ψ|2 – Квадрат функции показывает наибольшую вероятность местоположения данной частицы.
|